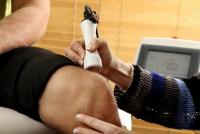
Роль антидепрессантов в лечении хронического болевого синдрома. Антидепрессанты и другие препараты при хронической боли в спине Как принимать амитриптилин при хронической боли спины
I. Острая, хроническая ипатологическая боль. Патофизиологические и клинические особенности хроническойболи. Основные виды хронических болевых синдромов. Нейрохимия хронической боли.
Острая боль
-симптом какой-либо внезапно возникшей
патологии или повреждения тканей. Острыйболевой синдром можно назвать физиологическим, поскольку он выполняетопределённую защитную функцию и, сигнализируя о развитии патологическихпроцессов в тканях, способствует развитию в организме адаптационных комплексныхреакций. Терапия острой боли обычно направлена на устранение причины, провоцирующейэту боль, либо на уменьшение её алгогенного действия (блокады).
Хроническая или рецидивирующаяболь
имеет многокомпонентное происхождение, в основе которого лежат нетолько патофизиологические, но и тесно взаимодействующие психологические исоциальные факторы. Хроническая боль также носит название патологической боли, вследствиетого, что она имеет
патогенное значение для организма, и, вызывая расстройствофункций ЦНС, психические и эмоциональные нарушения, ведёт к повреждениювнутренних органов.
Хроническая (патологическая) боль -самостоятельное заболевание с первичным патологическим процессом в соматическойсфере и вторичной дисфункцией периферической и центральной нервной системе.
Главныеотличия хронической (патологической) боли :
u длительность(не менее 3 - 6 мес.),
u повышениеустойчивости пациента к проводимой терапии,
u отсутствиепрямой зависимости от выявления и устранении вызвавшей её причины.
Типыхронической боли:
1) Боль в результате непрекращающегося длительного воздействия(грыжа межпозвонкового диска).
2) Боль после остройтравмы, но продолжающаяся значительно дольше нормального периода заживления(каузалгия, регионарный болевой синдром, фантомная боль).
3) Больбез определённой, видимой, заметной причины (головные боли мышечногонапряжения, мигрень).
§ Хроническая боль – это самостоятельное заболевание, в патогенезе котороговедущее значение имеют психо-эмоциональные и социальные факторы. При данномтипе боли может отсутствовать прямая связь между болью и вызвавшей её причиной.
§В механизмах развитияхронической боли и депрессии лежат общие медиаторные системы.
§Согласноэпидемиологическим исследованиям существует тесная связь между депрессией ихронической болью.
Известны различные классификациихронической боли.
В основебольшинства из них лежит локализация болевого синдрома :
o головные боли,
o боли в шее и спине,
o лицевые боли,
o боли в конечностях,
o боли в груди,
o боли в животе,
o боли в области таза.
Различают также боли соматического происхождения, нейрогенные и психогенные боли .В механизмахразвития хронической боли, независимо от её локализации и происхождения, важноезначение отводится медиаторным системам головного и спинного мозга:
v Серотонинергической
v Норадренергической
v Дофаминергической
v ГАМК-ергической
v Пептидергической (опиоидно и неопиоидной).
В ходемножества клинических и экспериментальных исследований установлено:
- Интратекальное введение серотонина вызывает анальгезию и угнетает активность нейронов дорзальных рогов спинного мозга, вызванных болевой стимуляцией.
- При введении в определённые зоны головного мозга (большое ядро шва) ингибиторов обратного захвата серотонина, что способствует высвобождению серотонина из синаптических терминалей, развивается анальгетический эффект.
- Избирательное разрушение нисходящих серотонинергических путей усиливает болевую реакцию.
При исследовании влияния адренергическоймедиаторной системы получены подобные результаты. Выяснено, что норадреналинмодулирует болевые сигналы, как на супрасегментарном, так и на спинальномуровнях. Вследствие чего, блокаторы адренергических рецепторов повышают болевуючувствительность, а агонисты (клофелин) тормозят активность ноцицептивныхнейронов в ответ на болевое раздражение.
II. Хроническая боль идепрессия.
По результатам многочисленных клинико -эпидемиологических исследований установилено, что существует тесная связь междухронической болью и депрессией. Распространению депрессии среди пациентов схронической болью колеблются от 30 до 87%. По мнению некоторых исследователей,депрессия - ведущий фактор в снижении трудоспособности у больных с хроническойболью, либо наиболее значимой мотивацией при обращении за медицинской помощью.Связь депрессивных расстройств и хронической боли не представляетсяоднозначной, и существsуют различные альтернативные варианты ихпричинно-следственных отношений:
1) Хроническая боль -причина депрессии.
2) Пациенты сдепрессией более склонны к восприятию болей.
3) Хроническая боль идепрессия опосредованно связаны другими промежуточными факторами (потерядееспособности).
III. Фармакотерапияхронической боли. Адъювантная терапия. Использование антидепрессантов в лечениихронической боли.
Основные группы препаратов используемыев медикаментозной терапии хронических болевых синдромов:
1. Анальгетики
· опиоидные,
· неопиоидные.
2. Адъювантныеанальгетики.
Адъювантные анальгетики (“коанальгетики”)
-гетерогенная группа лекарственных средств, которые обеспечивают анальгезию либопри специфических болевых синдромах, либо нейтрализуют побочные действияопиоидов, что позволяет продлить их анальгетический эффект. К ним относятсялекарственные средства, не обладающие прямыми анальгезирующими свойствами,
ноприобретающими их при определённых обстоятельствах (антигистаминные средства,транквилизаторы, антиконвульсанты и др.). Хроническая (патологическая) больпредставляет собой именно те условия, при которых применение адъювантных средствведёт к положительному эффекту. Среди последних значительное место принадлежитантидепрессантам.
В широкой клинической практике, к сожалению, назначение антидепрессантов врачамимотивируется лишь желанием вызвать седативный эффект и, тем самым, создать благоприятныйфон для основной терапии (анальгетиками). Между тем известно, что применениеантидепрессантов оказывает положительный эффект у 50-60% больных с ХБС. По данныхболее 60 клинических трайлов доказано анальгетическое действие антидепрессантовпри лечении большинства ХБС.
Антидепрессанты оказываютанальгетический эффект по трём основным механизмам :
1. Уменьшаютдепрессию.
2. Потенцируютдействие анальгетиков или эндогенных опиатных пептидов.
3. Обладаютсобственными анальгезирующими свойствами, которые заключаются в длительнойпролонгации синаптической активности норадреналина и серотонина.
Общим показанием для примененияантидепрессантов - ХБС , но некоторые болевые синдромы являются облигатнымпоказанием для их назначения.
К ним относятся :
· нейрогенные болевые синдромы (диабетическая невропатия,герпетическая невропатия, каузалгия и др.),
· некоторые виды первичных головных болей (головная боль мышечногонапряжения, мигрень, абузусная головная боль и др.).
IV. Фармакотерапияантидепрессантами ХБС.
В лечении хронического болевого синдромаприменяются антидепрессанты.
Антидепресанты - ингибиторы нейронального захвата нейромедиаторов:
v неизбирательные;
v избирательные.
К неизирательным антидепресантамотносятся трициклические и четырёхциклические антидепрессанты.
1. Трициклическиеантидепрессанты:
· амитриптилин,
· имипрамин,
· кломипрамин.
Фармакологическое действиепрепаратов этой группы заключается в ингибировании обратного захватанорадреналина и серотонина, что ведёт к накоплению данных нейромедиаторов вобласти рецепторов. Начальная доза трициклических антидепрессантов составляетот 10 до 25 мг вечером, перед сном, с последующим увеличением суточной дозы на10-25 мг каждые 3-7 дней до максимальной, составляющей от 75 мг (мигрень,головные боли напряжения) до 150 мг (нейропатические боли). Анальгетическийэффект возможен к концу первой недели, на 2-3 неделе наступает психотропныйэффект - улучшается настроение, повышается трудоспособность, исчезает тревожноеожидание боли. Лечение длится несколько месяцев с постепенной отменой.
Побочныеэффекты:
a) холинергические:
o сухость во рту,
o неясность и затуманивание зрения,
o запоры,
o задержкамочеиспускания,
o синусовая тахикардия,
o головокружение.
b) гистаминергические:
o сонливость,
o увеличение веса.
c) адренергические:
o ортостатическаягипотензия,
o кардиотоксичность.
2. Четырёхциклические антидепрессанты:
· мапротилин-лудиомил,
· миансерин-леривон.
Характеризуются преимущественнымдействием на норадренергическую трансмиттерную систему. Есть данные о эффективностиМиансерина (Леривона) при леченииголовных болей мышечного напряжения. Препарат обладает седативным эффектом.Миансерин с хорошим эффектом применяется при болях в нижней части спины в дозеот 10 до 30 мг в сутки.
Препараты этой группы отличаются минимальными побочными эффектами:
o сонливость,
o увеличение веса,
o ортостатическая гипотензия.
Селективные ингибиторы обратного захватасеротонина:
§ флуоксетин-прозак,
§ венфлаксин,
§ нефазодон,
§ сертралин-золофт,
§ пароксетин-паксил.
В лечениихронического болевого синдрома роль селективных ингибиторов противоречива ипока существует немного клинических трайлов, доказывающих их эффективность принейрогенных болях. Наиболее известен флуоксетин(прозак) при лечении головных болей: мигрени и, особенно, хроническихголовных болей напряжения. Рекомендовано принимать по 1 капсуле (20 мг) 1 раз всутки в течение 6-8 недель. Хороший эффект по данным отечественных авторов(А.М. Вейн, Т.Г. Вознесенская и др.) был получен у 65% пациентов. Флуоксетинвызывает статистически достоверное уменьшение частоты приступов и ихпродолжительности.
Селективныеингибиторы обладают минимальной антихолинергической и a-дренергичес-
кой блокирующей активностью.
Побочные эффекты:
o тошнота,
o рвота,
o тревожность
o беспокойство,
o сексуальная дисфункция,
o головные боли,
o возбуждение.
В таблице представлены различные группыантидепрессантов, различающихся по механизму своего действия.
Антидепрессанты (тимоаналептики,тимолептики)
Таблица1.
| А. Ингибиторы моноаминооксидазы (МАО) |
|
| а) необратимые ингибиторы МАО: § Nialamid, § Phenelsine | б) обратимые ингибиторы МАО: § Befolum, § Feprosidnin HCL |
| Б. Ингибиторы нейронального захвата: |
|
| а) неизбирательные ингибиторы нейронального захвата: | б) избирательные ингибиторы нейронального захвата: |
2. четырёхциклические антидепрессанты : § Maprotilin, § Mianserin | § Burtriptiline, § Fluoxetin, § Nefazodon, § Paroxetin, § Sertralin, § Venflaxin. |
| В . Антидепрессанты разных групп : § Cephedrinum, § Citalopram, § Tryptophan. |
|
| Г. Препараты других фармакологических групп с антидепрессивным действием: § Ademetionin. |
|
V. Оценка эффективностииспользования антидепрессантов в лечении ХБС.
В ходе обзора современной литературы оприменении антидепрессантов с целью анальгезии (Onghena, Van Houdenhove, 1992)в плацебо - контролируемых исследованиях, известно:
1. среди популяциибольных с ХБС, получающих антидепрессанты, в среднем, эффект встречается у 74%.
2. при использованииантидепрессантов, величина анальгетического эффекта не зависима отпреимущественно органической или психологической основы боли.
3. величинаанальгетического эффекта не зависит от антидепрессивной активности препарата,наличия маскированной депрессии, а также применения антидепрессантов в качествеседативных средств. Вследствие чего, антидепрессанты с более выраженнымседативным эффектом должны быть использованы у пациентов с нарушениями сна дляснижения риска привыкания к гипнотикам.
4. не существуеточевидных преимуществ в выборе антидепрессантов селективного действия(серотонина или норадреналина). Антидепрессанты, обладающие низкойселективностью в ингибировании обратного захвата моноаминов, обладают большиманальгезирующим эффектом.
Соотношение эффективности и осложнений, вызываемыхантидепрессантами (McQuay et al. 1996)
| Хронические болевые синдромы | NNT (number needed to treat) ЧБНЛ - число больных, которых необходимо лечить, чтобы достичь определённого эффекта) |
||
| Уменьшение боли (>50%) | Малые побочные эффекты | Большие побочные эффекты |
|
| Диабетическая нейропатия | 19,6 |
||
| Постгерпетическая невралгия | 19,6 |
||
| Атипичные лицевые боли | |||
| Центральные боли | |||
| Имипрамин | |||
| Дезипрамин | |||
| Комбинированные ТЦА | |||
| Пароксетин | |||
| Флуоксетин | 15,3 | ||
| Миансерин | |||
Любого происхождения. Их противоболевой эффект не связан с самим антидепрессивным действием.
Они сравнимы по эффективности с народными средствами http://golovnieboli.ru/drugie-stati/narodnye-sredstva-ot-golovnoj-boli . Наиболее широко из антидепрессантов применяют амитриптилин и имипрамин (мелипрамин).
Имипрамин сначала назначают по 10 мг/сут, потом дозу каждую неделю увеличивают до достижения эффекта (максимум до 150 мг/сутки). Препарат в меньшей степени, чем амитриптилин, дает седативный эффект, но из-за выраженного антихолинергического действия и неблагоприятного кардиологического влияния многие пациенты не могут длительно его принимать.
Трициклические антидепрессанты, особенно амитриптилин, может снижать вариабельность частоты сердечного ритма, усугублению кардиоваскулярной вегетативной дисфункции, усилению ортостатической гипотензии. Поэтому их с осторожностью назначают лицам с заболеваниями сердечно-сосудистой системы, вегетативной невропатией.
Ингибиторы обратного захвата серотонина (внимание — селективные) блокируют захват исключительно только серотонина.
Циталопрам (ципрамил) и паксил, но не флуоксетин, могут обладать самостоятельным противоболевым действием при некоторых вариантах невропатической боли — при диабетической полиневропатии.
Иногда при головных болях возможна комбинация в лечении малых доз три циклических антидепрессантов с некоторыми селективными ингибиторами захвата серотонина, имеющими короткий период полужизни (циталопрам). Циталопрам не тормозит активность микросома и ферментов печени, поэтому его комбинация с трициклическими препаратами более безопасна.
Вместе с тем, при общей хорощей переносимости СИОЗС нередко вызывают побочные эффекты со стороны желудка, кишечного тракта и даже могут повышать риск желудочных кровотечений (особенно при параллельном приеме НПС). Также, они способны вызывать сексуальную дисфункцию (нарушение эрекции у мужчин, аноргазмию у женщин), только усугубляя головную , причем пациенты с вегетативной невропатией могут быть особенно чувствительными к этому побочному действию.
При плохой переносимости, неэффективности только одних трициклических антидепрессантов возможно применение ингибиторов захвата и серотонина и норадреналина, например, венлафаксина (эффексора), до 225 мг/сут, дулоксетина 60 мг/сут.
Статью подготовил и отредактировал: врач-хирургВидео:
Полезно:
Статьи по теме:
- Практически у всех рано или поздно болит голова. Боли в голове входят в 20-ку самых...
- Кажется, что особенного если болит голова. Да у каждого второго она болит. Но боли бывают...
- Головные боли (ГБ) могут возникнуть при многократном приеме различных веществ. Особенно часто встречается так называемая...
Номер журнала: ноябрь 2006
Антидепрессанты используются не только в психиатрической практике, но и в практике неврологов и терапевтов. Неврологи назначают антидепрессанты для лечения депрессивных состояний у неврологических больных, хронических болевых синдромов и невропатической боли, панических атак, нарушений пищевого поведения, синдрома предменструального напряжения, превентивной терапии мигрени. Наиболее трудной задачей для невролога является выявление депрессивных расстройств, которые часто сопровождают неврологические заболевания. Сложности диагностики зависят от преобладания в неврологической и соматической практике атипичных, маскированных депрессий, легких или умеренных по степени тяжести или хронических субклинических ее вариантов, которые объективно трудно распознать . Больные, обращающиеся к неврологу, обычно не жалуются на типичные симптомы депрессии, прежде всего их беспокоит:
· постоянное чувство усталости;
· общая слабость;
· сниженная работоспособность;
· повышенная раздражительность;
· внутреннее напряжение и тревога;
· вегетативные проявления (сердцебиение, одышка, тошнота, сухость во рту, несистемное головокружение);
· постоянные болевые ощущения в различных частях тела: голове, спине, груди, животе или во всем теле;
· нарушения сна;
· расстройства аппетита и веса тела;
· снижение полового влечения;
· расстройства менструального цикла.
Распознать депрессию возможно, лишь будучи хорошо информированным о клинических проявлениях депрессии и нацеленным на ее диагностику.
Можно выделить целый ряд клинических проявлений, которые должны насторожить врача и заставить его подумать о депрессии. Прежде всего, это многочисленность, противоречивость, изменчивость жалоб, которые не соответствуют конкретному неврологическому или соматическому заболеванию, и несоответствие жалоб, которые предъявляет больной, объективным данным, полученным при осмотре или при помощи дополнительных методов обследования. Следует обращать внимание на специфику нарушений сна. Как правило, для типичной депрессии характерны ранние утренние пробуждения на два-три часа раньше обычного с чувством разбитости, плохого настроения, тоски, невыспанности. Однако при атипичной депрессии чаще встречаются трудности засыпания, неспокойный, поверхностный сон или гиперсомния. При типичной депрессии наблюдается снижение аппетита, существенное уменьшение количества ежедневно принимаемой пищи и связанное с этим значительное и быстрое снижение массы тела. При атипичной депрессии может выявляться, наоборот, повышенный аппетит с пристрастием к высокоуглеводной пище и повышение массы тела. Суточное распределение проявлений болезни с пиком плохого самочувствия в утренние часы и некоторое его улучшение к вечеру – достаточно характерная черта типичной депрессии. При атипичной депрессии, особенно в сочетании с тревогой, плохое настроение наряду с чувством усталости, разбитости, потери сил и энергии может нарастать в вечерние часы. К настораживающим симптомам можно отнести еще две характерные особенности: постоянное чувство усталости, которое не следует за какой-либо деятельностью, а предшествует умственной или физической нагрузке, и настойчивое и постоянное обращение за медицинской помощью, несмотря на полное отсутствие результатов лечения.
Существенное значение имеют особенности анамнеза, которые могут заставить врача заподозрить депрессию у пациента: сведения о депрессии у родственников больного, особенно первой степени родства; наличие в анамнезе у пациента эпизодов плохого самочувствия со сходными симптомами, особенно сезонные обострения в осенне-зимний период; депрессивные эпизоды, суицидальные попытки, прием психотропных средств в анамнезе самого пациента.
Виды депрессий у неврологических больных весьма многообразны. Депрессия может развиваться у больных с текущим органическим неврологическим заболеванием ЦНС. По данным разных авторов, депрессия диагностируется при синдроме паркинсонизма от 30 до 90 % случаев . При болезни Паркинсона депрессия наблюдается почти у половины больных. Более того, болезнь Паркинсона в 12 % случаев может дебютировать с депрессивной симптоматикой, которая опережает двигательные проявления болезни, что существенно затрудняет диагностику .
Постинсультная депрессия, по данным Robinson et al. (1987), Morris et al. (1990), House et al (1991), развивается у 20-50 % пациентов в первый год после развития инсульта. Выраженность постинсультной депрессии зависит от многих причин: локализации инсульта, степени неврологического дефекта, возраста больного, стадии и срока инсульта . Статистические данные колеблются в зависимости от подтипа депрессии. Так, по данным Chemerinski, Robinson (2000), большая депрессия встречается у постинсультных больных с частотой от 0 до 25 %, а малая депрессия – с частотой от 10 до 30 % . Наибольшая частота депрессий встречается у больных в поздний восстановительный период инсульта.
Депрессивные расстройства могут развиваться одновременно с симптомами прогрессирующей деменции. Причем депрессия наблюдается чаще при сосудистой деменции, чем при болезни Альцгеймера. Статистические данные весьма противоречивы: так, по данным McPherson S, Cummings J. (1997), депрессия при сосудистой деменции наблюдается в широчайшем диапазоне от 0 до 71 %, составляя в среднем 30 % . Дифференциальная диагностика деменции и депрессии весьма сложна, так как ряд симптомов у этих двух состояний идентичен. Именно в связи с этим широко используется термин псевдодеменция, которым обозначают снижение когнитивных функций, характерное для депрессии.
Депрессия может формироваться и в связи с поражением мозга гипоксического, аутоиммунного, метаболического, интоксикационного характера, при патологическом изменении гормонального статуса, что наблюдается при целом ряде соматических и эндокринных заболеваний: поражении почек и печени, сердечно-сосудистой и легочно-сердечной недостаточности, гиперпаратиреоидизме, гипотиреозе, сахарном диабете, патологически протекающем климаксе, синдроме предменструального напряжения, первичном гиперкортицизме, болезни Аддисона, авитаминозах (особенно В12 дефицитной анемии), заболеваниях желудочно-кишечного тракта (язвенной болезни, гастритах, энтероколитах, гепатитах, циррозах), онкологических заболеваниях, системной красной волчанке, ревматоидном полиартрите.
Другим вариантом депрессии является реактивная или психогенная депрессия как следствие воздействия психотравмирующей ситуации или как ответ на острый эмоциональный стресс. Один из вариантов развития депрессии – это реактивное состояние в ответ на болезнь.
Связи депрессии и органического неврологического заболевания можно представить следующим образом :
Для диагностики депрессии необходимо использовать принятые диагностические критерии (МКБ-10).
К основным проявлениям депрессии относятся:
К дополнительным проявлениям депрессии относятся:
Важным диагностическим критерием является обязательное присутствие основных депрессивных проявлений практически ежедневно, большую часть дня и не менее двух недель.
При легком депрессивном эпизоде (субдепрессии) основные проявления депрессии выражены слабо и неотчетливо. Достаточно присутствие двух из трех основных симптомов и двух дополнительных. В клинической картине может доминировать один моносимптом – повышенная утомляемость, снижение энергии, нарушения сна или аппетита. Депрессивные проявления могут быть замаскированы тревожными, болевыми, вегетативными жалобами. Никакого снижения социального или профессионального функционирования не наблюдается.
При депрессии средней тяжести должны присутствовать два основных и три или четыре дополнительных симптома. Они выражены умеренно, при этом определяются некоторые затруднения в социальном и профессиональном функционировании.
При тяжелой депрессии все три основных депрессивных симптома отчетливо и ярко выражены. Широко представлены (более четырех) дополнительные депрессивные симптомы. Выявляются суицидальные тенденции. Наблюдаются выраженные нарушения социального функционирования и неспособность к профессиональной деятельности. Тяжелую депрессию лечат только психиатры!
Если депрессивное расстройство длится более двух лет, диагностируют хроническую депрессию или дистимии.
В неврологической практике часто наблюдаются атипично протекающие, соматизированные (маскированные, скрытые, вегетативные) депрессии. При такой депрессии больной может не предъявлять собственно депрессивные жалобы, а постоянно испытывать стойкие соматические симптомы, чаще других – постоянное чувство усталости и хроническую боль или многочисленные вегетативные ощущения. Следует подчеркнуть частую встречаемость при маскированной депрессии ипохондрических, астенических и тревожных расстройств, которые нередко выходят на первый план, затмевая собственно депрессивные симптомы. Особенно специфично сочетание тревоги и депрессии при хронических болевых синдромах и при панических атаках .
Хронические болевые синдромы и депрессия сочетаются весьма часто, в 50-60 % случаев. По данным Смулевича А.Б., стойкие идиопатические алгии являются одной из наиболее распространенных в общемедицинской практике «маской» депрессии . Хронический болевой синдром может иметь различную локализацию. Нередко у больных формируется особое «болевое поведение», при котором они щадят больную часть тела: избегают физических нагрузок, осторожно двигают головой, соблюдают строгую диету, постоянно растирают болевую точку и т. д. При маскированных депрессиях жалобы на боли хронического характера сочетаются с жалобами на другие неприятные, плохо описываемые и нередко плохо локализуемые ощущения во всем теле, на нарушения сна, аппетита, полового влечения, повышенную утомляемость, недомогание, учащенное сердцебиение, запоры, диспепсии. Наиболее часто депрессия лежит в основе формирования ежедневных хронических головных болей, куда входят хроническая мигрень и хронические головные боли напряжения. В этих случаях именно присоединившаяся депрессия играет решающую роль в трансформации мигрени и эпизодической головной боли напряжения в хронические формы, при которых головная боль возникает с частотой от 15 раз в месяц до ежедневной.
Среди всех хронических болевых синдромов лидером по представленности депрессии является фибромиалгия . Следует подчеркнуть, что при любом происхождении хронического болевого синдрома он почти неизбежно сосуществует с той или иной степенью депрессивных расстройств. Депрессия может быть реакцией на выраженный, длительно существующий болевой синдром, присоединяясь к нему, она всегда усугубляет, видоизменяет и хронифицирует болевой синдром. С другой стороны, болевой синдром может быть «маской» депрессии, т. е. являться одним из клинических проявлений соматизированной депрессии. Таким образом, депрессия может быть как первичной, так и вторичной по отношению к болевому синдрому. «Родственность» боли и депрессии имеет и нейротрансмиттерную основу, в основном это недостаточность моноаминов и ГАМК, повышенная активность глютамата, нарушение взаимовлияния глютаматергических и моноаминергических систем, нарушение метаболизма Р-субстанции и нейрокининов, что характерно для обоих патологических состояний .
Последствия длительно существующих нелеченых депрессивных состояний весьма велики. Это прежде всего: значительное снижение качества жизни пациента, ухудшение течения любых органических неврологических и соматических заболеваний, замедление выздоровления и восстановления неврологических функций, хронификация депрессивного состояния и возрастание риска суицида. Последнее время методами нейровизуализации и нейроморфологии получены доказательные данные о том, что длительно существующая депрессия приводит к органическим изменениям в головном мозге (данные ПЭТ, КТ, МРТ, патоморфологические изменения) .
Патогенез депрессивных состояний достаточно сложен, и его изучение продолжается и по сей день . Основными являются «классическая» моноаминовая теория депрессий и «рецепторная» модификация моноаминовой гипотезы, согласно которым в основе депрессии лежат функциональные нарушения синтеза и обмена моноаминов: в основном серотонина и норадреналина в синаптической щели, а также увеличение числа и повышенная чувствительность постсинаптических моноаминергических рецепторов. Активно обсуждается генная теория депрессии, которая предполагает, что в происхождении заболевания значительную роль играют изменения работы критически важных генов, от которых зависит нейрорегуляторная деятельность нейротрофических факторов и соответственно нормальное функционирование нейронов. Деятельность этих генов в свою очередь регулируется через воздействие моноаминов на рецепторы постсинаптической мембраны через сложный каскад химических процессов внутри клетки . Для обсуждения патогенеза депрессии в последнее время широко привлекают понятие нейрональной пластичности, нарушения которой при этом заболевании связывают со стресс-индуцированной гиперреактивностью гипоталамо-гипофизарно-надпочечниковой оси и соответственно гиперактивностью кортикотропин-релизинг фактора, АКТГ и кортизола. Это приводит к снижению активности мозгового нейротрофического фактора, нарушению метаболизма фосфолипидов и Р-субстанции, нарушению активности NMDA-рецепторов с усилением токсического влияния глютамата на нейроны .
В лечении депрессий основное место занимают антидепрессанты, восстанавливающие уровень моноаминов в синаптической щели и нормализующие состояние постсинаптических рецепторов. В последнее время получены данные о положительном влиянии антидепрессантов на процессы нейрональной пластичности через снижение стресс-индуцированной гиперреактивности гипоталамо-гипофизарно-надпочечниковой оси, повышения уровня мозгового нейротрофического фактора. Антидепрессанты действуют и как антагонисты NMDA-рецепторов, способствуя снижению токсического влияния глютамата на нейроны и восстанавливая баланс между глютаматэргическими и моноаминэргическими системами . Также имеются данные о снижении уровня Р субстанции в ЦНС под влиянием антидепрессантов . Приведенные данные об улучшении нейропластичности под влиянием антидепрессантов весьма значимы для невролога, так как помогают осознать, насколько существенно использование антидепрессантов при лечении депрессии у больных с органической неврологической патологией.
При выборе антидепрессанта для невролога приоритетна хорошая переносимость препарата. В связи с этим, несмотря на то что трициклические антидепрессанты (ТЦА) не потеряли своей актуальности и широко используются в психиатрии, их применение в неврологической и соматической практике должно быть ограничено . Это связано с тем, что ТЦА блокируют и альфа-адренергические, и холинергические (мускариновые) и Н-1 гистаминовые рецепторы, с чем и связаны в основном их многочисленные выраженные побочные явления (ортостатическая гипотензия, головокружение, тахикардия, нарушение памяти и снижение других интеллектуально-мнестических функций, диплопия, сухость во рту, запоры, задержка мочи, седация, увеличение веса тела, усиление аппетита) . ТЦА обладают кардиотоксичностью и выраженными лекарственными взаимодействиями. Следует учитывать и их поведенческую токсичность – замедление психомоторных функций и нарушение когнитивных процессов, которые нарушают повседневную жизнь пациента. В связи с этим желательно выбирать современные антидепрессанты обладающие наименьшими побочными эффектами: селективные серотонинергические антидепрессанты (СИОЗС) и селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН). Именно эти препараты наилучшим образом зарекомендовали себя в неврологической практике.
Основные представители СИОЗС – флуоксетин (Прозак, Флувал), сертралин (Золофт, Асентра), пароксетин (Паксил), флувоксамин (Феварин), циталопрам (Ципрамил), эсциталопрам (Ципралекс). По антидепрессивной активности в лечении легких, умеренных, соматизированных депрессий и дистимии эти препараты не уступают ТЦА. При этом у них отсутствуют побочные эффекты, свойственные ТЦА, а собственные побочные эффекты редки и обычно не требуют отмены препарата. В связи с этим они широко используются в амбулаторной практике. СИОЗС обладают широким спектром клинического действия с выраженным антидепрессивным, антиагрессивным, антипаническим, противотревожным, аналгетическим действием . Они хорошо нормализуют сон. Ниже перечислены заболевания, при которых СИОЗС оказывают хороший терапевтический эффект:
В неврологических и соматических стационарах у больных с сопутствующей неврологической и соматической патологией, особенно пожилого возраста, следует отдавать предпочтение препаратам группы СИОЗС, которые легче переносятся, не токсичны, не нарушают внимание, память и мыслительные процессы, не ухудшают функционирования внутренних органов и наименее безопасны для пациентов с соматической патологией сердечно-сосудистой системы, заболеваниями легких, почек, желудочно-кишечного тракта, хорошо сочетаются с препаратами, применяемыми в неврологии и терапии, не повышают веса тела. Их также активно используют для лечения хронических болевых синдромов и для превентивного лечения мигрени, актуальность лечения которой в неврологической практике очень велика, поэтому остановимся на этом подробнее.
Распространенность мигрени в популяции достигает 10-15 %. Чаще ею страдают женщины. Пик распространенности приходится на зрелый возраст 35-40 лет. Чаще в клинической практике встречается простая мигрень без ауры, которая составляет от 60 до 70 % всех случаев заболевания. Мигрень значительно нарушает повседневную жизнь пациента: у 51 % больных снижаются профессиональные возможности, у 67 % – возможности исполнения домашних обязанностей, 53 % пациентов во время приступов требуется постельный режим из-за тяжести состояния, 34 % пациентов сообщают, что из-за приступов не могут планировать и контролировать свою жизнь, 66 % испытывают постоянный страх, что могут подвести коллег по работе, у 54 % больных из-за приступов ухудшаются отношения с родными. . Учитывая эти данные, считается, что нуждаются в профилактическом лечении мигрени 53 % пациентов, а получают это лечение только 10 % . Показаниями к использованию профилактического лечения при мигрени являются: более двух приступов в месяц; выраженная интенсивность болевого синдрома и сопутствующей симптоматики; длительность как самого приступа, так и пред- и постприступного периодов; неэффективность средств для купирования самого приступа или необходимость постоянного увеличения их дозировок; противопоказания для применения препаратов, купирующих приступ; снижение качества жизни.
Основные цели профилактической терапии: уменьшение частоты, длительности и тяжести приступов; уменьшение количества препаратов, применяющихся для купирования приступа, что позволяет предотвращать лекарственно зависимые головные боли и хронификацию мигрени; уменьшение влияния приступов на повседневную жизнь; защита от потенциального прогрессирования заболевания и его грозных осложнений (мигренозный статус, мигренозный инсульт, хроническая мигрень). Антидепрессанты из группы СИОЗС хорошо себя зарекомендовали как средства превентивного лечения мигрени. Их следует назначать в достаточных дозах на срок не менее 3-4 месяцев.
Следует выделить еще одну группу препаратов, которые относятся к транквилизаторам, но обладают и антидепрессивными свойствами. С.Н. Мосолов относит их к классу переходных антидепрессантов . Наиболее эффективный и широко известный препарат этой группы – альпразолам (Ксанакс, Хелекс). Препарат эффективен при легких тревожных депрессиях, смешанных тревожно-депрессивных расстройствах, генерализованных тревожных расстройствах, панических атаках, нарушениях сна. Альпразолам начинает действовать раньше, чем классические антидепрессанты. Собственно тимоаналептические его свойства выражены слабо, но очень сильны анксиолитические и антифобические.
При выборе антидепрессанта необходимо учитывать их дополнительные клинические эффекты: противотревожный, антипанический, седативный, стимулирующий, аналгетический, вегетостабилизирующий, гипнотический. Для невролога очень важен аналгетический эффект антидепрессантов. Их эффективность в лечении хронических болевых синдромов достигает 75 %. Эффективность антидепрессантов тем выше, чем большую роль в хронической боли играет депрессия. Однако противоболевой эффект антидепрессантов реализуется не только через редукцию депрессивной симптоматики. Они способны потенцировать активность как экзогенных, так и эндогенных аналгетических веществ, в основном опиоидных пептидов, а также стимулировать серотонинергические и норадренергические антиноцицептивные системы. Получены данные о нормализации метаболизма Р-субстанции под влиянием антидепрессантов . Аналгетический эффект антидепрессантов наступает быстрее, чем собственно антидепрессивное действие. Длительность лечения антидепрессантами должна быть достаточной. Основную лечебную дозу следует назначать на срок не менее 8 недель, поддерживающая терапия продолжается не менее полугода. В ряде случаев для предотвращения рецидива заболевания невролог назначает антидепрессанты на более длительный срок.
При назначении курса лечения надо помнить, что клинический эффект антидепрессантов начинает проявляться к концу второй-третьей недели терапии. Необходим учет побочных действий препарата. Для избежания грозных осложнений врачу, не являющемуся психиатром, никогда не следует сочетать два антидепрессанта друг с другом из-за опасности потенцирования побочных эффектов.
При выборе антидепрессанта необходимо учитывать степень его токсичности и возможность летального исхода при случайной или преднамеренной (попытка суицида) передозировке препарата.
Таким образом, применение антидепрессантов помогает не только эффективно купировать депрессию, но и значительно улучшить течение органического неврологического заболевания, способствовать лучшему восстановлению функций, повысить качество жизни больного. Антидепрессанты назначаются неврологами для терапии легких и средних степеней депрессии, а также используются для лечения хронических болевых синдромов любой локализации, невропатической боли, профилактики мигренозных приступов, купирования симптомов патологически протекающего климакса, синдрома предменструального напряжения, панических атак. Еще раз следует подчеркнуть, что неврологам и терапевтам надо отдавать предпочтение антидепрессантам второго и третьего поколений (СИОЗС, СИОЗСН), которые легко переносятся, не токсичны, безопасны при передозировке, не обладают поведенческой токсичностью, имеют минимум лекарственных взаимодействий.
Литература
За последние несколько десятилетий проведено невероятное количество различных по своему методологическому качеству клинических исследований по оценке эффективности и безопасности антидепрессантов в терапии пациентов с различными типами болевых синдромов. Показана эффективность антидепрессантов на фоне хронических неспецифических и специфических болевых синдромах, в частности на фоне остеоартрита и ревматоидного артрита, фиброзита, фибромиалгии (Fishbain D., 2000) (Strumpf M., 2001).
Трициклический антидепрессант амитриптилин, в том числе в низких дозах, относится к числу одних из самых назначаемых антидепрессантов (Lockhart P., 2011). Orbai A.M.и Meyerhoff J.O. опубликовали обзор, в котором приводятся результаты ретроспективного анализа исходов терапии пациентов с хронической поясничной болью и люмбарным стенозом позвоночника с применением трициклических антидепрессантов в малых дозах, включая амитриптилин. Так, из 26 пациентов у 20 отмечалось улучшение картины болевого синдрома.
Причем большинство пациентов отмечали улучшения уже при приеме амитриптилина или нортриптилина в дозе 10 мг, которая оставалась на том же уровне в ходе дальнейшего лечения. Число пациентов с поясничными болями, сочетавшимися с иррадиацией в ногу, улучшение симптоматической картины, было достоверно выше в сравнении с числом пациентов только с болью в спине. Таким образом, было показано, что трициклические антидепрессанты являются эффективным терапевтическом методом контроля болевого синдрома в популяции пациентов с поясничным стенозом позвоночника (Orbai A.M., Meyerhoff J.O., 2010).
В рандомизированном, двойном слепом, плацебо-контролируемом исследовании с участием 78 мужчин с хронической поясничной болью, получавших терапию трициклическим антидепрессантом нортриптилином в дозах 50-150 нг/мл в течение 8 недель, отмечалось достоверное снижение оценок интенсивности и характера боли (Descriptor Differential Scale ) и нетрудоспособности (Impact Profile ). Достоверных различий в оценках качества жизни, связанного со здоровьем (Quality of Well-Being Scale ) настроения (Beck Depression Inventory, Spielberger State Anxiety Inventory, Hamilton Anxiety/Depression Rating Scales ) и клинических исходов болевого синдрома, оцениваемого исследователями (Clinical Global Impression) значимо не различались между группами нортриптилина и плацебо. Таким образом, было подтверждено наличие анальгетической активности нортриптилина в сравнении с плацебо, причем автономно от его антидепрессантного действия (Atkinson J.H., Slater M.A., Williams R.A., 1999).
Так, в одном психометрическом исследовании проводилась оценка потенциального влияния психологических факторов на ответ пациентов с хроническими поясничными болями, получающими лечение антидепрессантом кломипрамином. В исследовании приняли участие 30 госпитализированных пациентов с хронической болью в пояснице, получавших внутривенные инъекции антидепрессанта в течение первых 10 дней исследования и далее внутрь в таблетках в течение 20 дней.
Психологическое тестирование проводили с использованием валидированного опросника Minnesota Multiphasic Personality Inventory. Также в дни 0, 4, 10 и 30-й дни использовали тесты Saint Antoine Questionnaire , ВАШ , Schöber"s maneuver и проводили общее обследование. Так, первоначально до инициирования терапии у пациентов отмечались высокие оценки MMPI , что указывало на наличие ипохондрии, депрессии и истерии. Эти оценки достоверно снижались у 76% пациентов (n=23) к 30-му дню исследования.
Из 13 пациентов с высокими оценками по ипохондрии и истерии у 5 эти оценки значительно снижались в ходе госпитализации и возвращались к исходным значениям после возвращения домой. Таким образом, было показано, что ответ на лечение кломипрамином лучше у недепрессивных пациентов. Причем ипохондрия и истерия являются лучшими предикторами ответа на лечение антидепрессантами. Эти данные могут использоваться при отборе пациентов с хроническими спинальными болями, которые могут продемонстрировать максимальный ответ на лечение антидепрессантом (Fouquet B., 1997).
В другом клиническом исследовании проводилось сравнение эффектов доксепина и дезипрамина в дозах 188 мг/день и 173 мг/день соответственно в терапии 36 добровольцев с хроническими спинальными болями и аффективными или дистимическими расстройствами. Терапия обоими антидепрессантами ассоциировалась с достоверным редуцированием симптомов депрессии (70%). Интенсивность боли также снижалась в обеих группах (ответ у 50% пациентов). При этом тяжесть боли снижалась более интенсивно в группе доксепина. Уровень β-эндорфина в спинномозговой жидкости не изменялся на фоне лечения (Ward N., 1984). В другом рандомизированном исследовании доксепин продемонстрировал способность индуцировать нежелательные явления со стороны автономной нервной система (антихолинергические эффекты) и седацию (Amsterdam J.D., 1982).
Hameroff S.R. и соавт. опубликовали результаты 6-недельного, рандомизированного, двойного слепого клинического исследования по оценке эффективности доксепина в терапии хронической боли в спине и шее, проводившегося с участием 36 пациентов. Так, терапия антидепрессантом приводила к достоверному улучшению симптоматической картины депрессии (Hamilton depression scores ), тяжести боли (Global Assessment Scale scores) , снижению негативного влияния боли на активность пациентов, улучшению сна и мышечного напряжения. Некоторые из этих положительных изменений отмечались уже через 1 неделю после начала приема. Доза доксепина в исследовании составляла 200 мг/день, а концентрация доксепина и его метаболита нор-доксепина в плазме крови добровольцев в среднем составляла 80 нг/мл.
Терапия доксепином не ассоциировалась с нежелательными явлениями. Достоверных изменений концентраций β-эндорфина и/или энкефалина в спинномозговой жидкости не отмечалось (Hameroff S.R., 1984). Таким образом, доксепин может рассматриваться в качестве потенциального адъювантного анальгетика в терапии пациентов с хронической болью на фоне депрессии (Aronoff G.M., Evans W.O., 1982).
Воробьева О.В. и Акарачкова Е.С. представили результаты клинического наблюдения 20 пациентов с хронической дорсалгией, получавших антидепрессант тианептин (Коаксил®) в дозе 12,5 мг 3 раза в день. Согласно результатам психометрического тестирования у 90% пациентов отмечались признаки депрессии. Терапия тианептином в течение 6 недель ассоциировалась с редуцированием картины депрессии, ослаблением мышечной дисфункции и болевого синдрома. Также отмечалась положительная динамика автономной дисфункции, нарушений сна и качества жизни. Таким образом, авторы отметили, что тианептин является высокоэффективным и безопасным методом терапии депрессии на фоне хронических болей в спине и оказывает позитивное влияние на болевой синдром (Воробева О.В., Акарачкова Е.С., 2004).
В одном открытом, сравнительном исследовании, проводившемся в России, проведена оценка эффективности и переносимости препарата венлафаксина пролонгированного действия (Велаксин) в дозе 75 мг/день в течение 8 недель в терапии 48 пациентов с подострыми или хроническими болями на фоне спондилогенной дорсопатии. Интенсивность анальгетического действия антидепрессанта оценивали на основании средних оценок по шкалам ВАШ и VPS 34 , ограничения ежедневной активности по опроснику Modified Pain Disability Questionnaire (mPDQ) , а также измеряли оценки тревожности и депрессии.
Catad_tema Болевые синдромы - статьи
Фармакотерапия хронического болевого синдрома неракового происхождения
Н.В. Стуров
Кафедра общей и клинической фармакологии РУДН, Москва
Хронический болевой синдром (ХБС) является компонентом клинической картины многих заболеваний, что предопределяет его высокую распространённость: только в США ХБС страдают приблизительно 86 млн. человек, а ежегодные социально-экономические потери, связанные с терапией ХБС и утратой трудоспособности, оцениваются в 90 млрд. долларов . Знание патофизиологических механизмов ХБС и более широкое использование при этом состоянии некоторых противоэпилептических препаратов (ПЭП) и антидепрессантов (АД) позволят оказывать больным более качественную медицинскую помощь .
Виды болевых синдромов
При проведении дифференциальной диагностики болевых синдромов неракового происхождения важно помнить о принципиальных отличиях острой и хронической боли, Острая боль эволюционно является защитным механизмом на экзо- или эндогенное повреждение и передаётся ноцицептивной системой. Хроническая боль чаще представляет собой неадекватно высокий, продолжительный и стойкий ответ на те или иные повреждающие факторы и может передаваться как ноцицептивно, так и существовать на основе патологической межнейронной циркуляции импульсов преимущественно на центральном уровне (нейропатическая боль). Исходя из этих представлений, при лечении ноцицептивной боли традиционно используют анальгетики или нестероидные противовоспалительные средства (НПВС). Для терапии нейропатической боли применяют средства, воздействующие на систему нейротрансмиттеров (АД и ПЭП) .
Пациенты с нейропатическим болевым синдромом предъявляют жалобы на жгучие, колющие, стреляющие или ноющие боли, сопровождающиеся дрожью, парестезиями, чувством онемения. Характерна аллодиния – чувство боли, вызываемое нормальными, безболезненными стимулами. Боль обычно усиливается в ночное время или при физических нагрузках.
При установлении ХБС неракового происхождения необходимо определить, какая именно его разновидность (периферическая нейропатическая боль, центральная нейропатическая боль или боль, не связанная с нейропатией) имеется у пациента, что окажет влияние на терапевтическую тактику (табл. 1).
Таблица 1
. Причины хронического болевого синдрома неракового происхождения
| Периферическая нейропатическая боль | Центральная нейропатическая боль | Боль, не связанная с нейропатией, или ненейропатическая (элементы нейропатической боли могут накладываться на основную симптоматику) |
|---|---|---|
|
|
|
Механизм действия ТЦА и ПЭП
Передача болевых импульсов по спинному и головному мозгу осуществляется при участии возбуждающих и тормозящих нейротрансмиттеров, а также лимитируется степенью активности натриевых и кальциевых каналов. Норадреналин, серотонин и в наибольшей степени гамма-аминомасляная кислота (ГАМК) являются физиологическими ингибиторами болевой передачи. Антидепрессанты и противоэпилептические препараты облегчают болевой синдром путём воздействия на указанные нейротрансмиттеры и ионные каналы (табл. 2).
Таблица 2
. Механизмы действия АД и ПЭП при ХБС
ТЦА воздействуют на болевую передачу на уровне спинного мозга, ингибируя обратный захват норадреналина и серотонина, которые накапливаясь, тормозят передачу болевых импульсов. Агонизм в отношении Н 1 -гистаминовых рецепторов и связанная с этим седация коррелирует с анальгетическим действием ТЦА. Амитриптилин эффективен так же у пациентов с острой болью .
ТЦА удобно разделить на производные вторичного и третичного амина. Вторичные амины (нортриптилин, дезипрамин) довольно селективно блокируют нейрональный захват норадреналина. Третичные амины (амитриптилин, имипрамин) практически в равной степени ингибируют захват норадреналина и серотонина, а также обладают выраженным холинолитическим действием .
«Новые антидепрессанты» венлафаксин и дулоксетин ингибируют обратный нейрональный захват норадреналина и серотонина, не воздействуя на другие нейрорецепторы, в том числе не обладают холинолитическим действием. Механизм действия бупропиона связан с блокадой обратного захвата дофамина (остальные механизмы действия препарата изучены не до конца) .
ПЭП угнетают возбуждение в нейронах и усиливают процессы торможения. Эти препараты воздействуют на вольтаж-зависимые (натриевые и кальциевые) и лиганд-зависимые ионные каналы, на специфические рецепторы глутамата и N-метил-D-аспартата, а также возбуждают глициновые и ГАМК-рецепторы (табл. 3) . Некоторые сведения о препаратах, которые можно использовать при ХБС, приведены в таблице 3.
Таблица 3
. Антидепрессанты и ПЭП, применяемые при ХБС
| Препарат | Доза | Неблагоприятные побочные реакции (НПР), противопоказания, комментарии |
|---|---|---|
| Антидепрессанты | ||
| ТЦА | НПР: сухость во рту, запор, задержка мочи, седация, увеличение массы тела | |
| Амитриптилин, имипрамин | 10–25 мг; наращивают по 10–25 мг/нед до дозы от 75 до 150 мг на ночь | Выраженное холинолитическое действие, нельзя использовать в пожилом возрасте |
| Дезипрамин, нортриптиллин | 25 мг утром или на ночь; наращивают по 25 мг/нед до 150 мг/сут | Менее выраженное холинолитическое действие |
| СИОНЗС | ||
| Флуоксетин, пароксетин | 10–20 мг/сут, до 80 мг/сут при фибромиалгии | НПР: тошнота, седация, снижение либидо, головная боль, увеличение массы тела; эффект при ХБС слабый |
| «Новые» антидепрессанты | ||
| Бупропион | 100 мг/сут, нарашивают по 100 мг/нед до 200 мг 2 р/сут | НПР: тревога, инсомния или седация, потеря веса, припадки (при дозе выше 450 мг/сут) |
| Венлафаксин | 37,5 мг/сут, наращивают по 37,5 мг/нед до 300 мг/сут | НПР: головная боль, тошнота, повышенное потооделение, седация, артериальная гипертензия, припадки; серотонинергические эффекты в дозе ниже 150 мг/сут; серотонин- и норадренергические эффекты в дозе выше 150 мг/сут |
| Дулоксетин | 20–60 мг/сут в 1–2 приёма при депрессии, 60 мг/сут при фибромиалгии | НПР: тошнота, сухость во рту, запор, головокружение, инсомния |
| ПЭП | ||
| I поколение | ||
| Карбамазепин 1 (Финлепсин) | 200 мг/сут, наращивают по 200 мг/нед до 400 мг 3 р/сут (1200 мг/сут) | НПР: головокружение, диплопия, тошнота, апластическая анемия |
| Фенитоин | 100 мг на ночь, дозу наращивают еженедельно до 500 мг на ночь | НПР: тошнота, головокружение, атаксия, невнятная речь, беспокойство, нарушение кроветворения, гепатотоксичность |
| II поколение | ||
| Габапентин 1 | 100–300 мг на ночь, наращивают по 100 мг каждые 3 дня до 1800–3600 мг/сут на 3 приёма | НПР: сонливость, утомляемость, головкружение, тошнота, седация, увеличение массы тела |
| Прегабалин 1 | 150 мг на ночь при диабетической нейропатии; 300 мг 2 р/сут при постгерпетической невралгии | НПР: сонливость, утомляемость, седация, головокружение, тошнота, увеличение массы тела |
| Ламотриждин | 50 мг/сут, наращивают по 50 мг каждые 2 нед до 400 мг/сут | НПР: сонливость, запор, тошнота, редко жизнеугрожающие кожные реакции |
Клиническая эффективность АД и ПЭП при ХБС
Нейропатическая боль
Эффективность ТЦА в лечении нейропатической боли подтверждена в клинических исследованиях. Другие АД демонстрируют вариабельный эффект при этой патологии. Так, неселективные АД или АД с норадренергической активностью обладают наибольшей эффективностью при нейропатической боли. Амитриптилин и нортриптилин имеют наибольшую доказательную базу из всех АД при терапии нейропатических и ненейропатичеких болевых синдромов . Эффект ТЦА коррелирует с их антидепрессивным действием . Препараты с серотонинергической активностью (типа флуоксетина), как правило, неэффективны в терапии ХБС.
Традиционно при лечении пациентов с нейропатической болью применяют ПЭП, причём чаще других используется препарат первой генерации карбамазепин, особенно при наличии тригеминальной и постгерпетической невралгии , а также болевого синдрома на фоне диабетической нейропатии . Частота купирования болевого синдрома при тригеминальной невралгии на фоне приёма карбамазепина колеблется, по данным разных авторов, в пределах 58–90%, а при диабетической нейропатии достигает 63%, что наравне с экономической доступностью определяет широкое использование препарата при этих заболеваниях .
ПЭП II поколения тоже имеют убедительную базу в плане эффективности при нейропатической боли. В клинических исследованиях габапентин оказался эффективнее плацебо у пациентов с диабетической нейропатией и постгерпетичекой невралгией . Аналогичными свойствами обладает прегабалин .
Ламотриджин продемонстрировал эффективность при тригеминальной невралгии , невралгии, ассоциированной с ВИЧ-инфекцией и постинсультном болевом синдроме . Препарат неэффективен у пациентов с неспецифической рефрактерной нейропатической болью . Длительное использование ламотриджина во многом ограничивается риском развития опасных для жизни кожных реакций.
АД и ПЭП в целом сравнимы по эффективности при ХБС, особенности имеются лишь в использовании и переносимости препаратов внутри этих групп . Данные различных мета-анализов при сравнении АД и ПЭП рознятся от достоверных различий до отсутствия таковых при терапии нейропатической боли . Например, в одном из двойных слепых рандомизированных исследований не было выявлено отличий в эффективности и переносимости между габапентином и амитриптилином .
Ненейропатическая боль
В большинстве случаев при различных ненейропатических болевых синдромах эффективны ТЦА (хотя выраженность их действия может снижаться с течением времени) , остальные АД и ПЭП активности при этих состояниях не демонстрируют.
АД имеют среднюю степень эффективности в редуцировании выраженности болевого синдрома и беспокойства, улучшении сна и общего состояния больных фибромиалгией. Сравнительный анализ различных схем лечения фибромиалгии затруднен из-за несоответствия критериев оценки клинического результата. Во многих исследованиях демонстрируется сравнимость эффектов большинства АД, транквилизаторов, циклобензаприна и НПВС, но обращает на себя внимание высокая активность амитриптилина .
Флуоксетин оказывает значимое действие при болевом синдроме на фоне фибромиалгии в дозе 80 мг/сут и не обладает таковым в дозе 20 мг/сут . Циклобензаприн (миорелаксант, являющийся по структуре трициклическим соединением) обладает при фибромиалгии слабо выраженным действием .
Из ПЭП эффективными средствами при фибромиалгии считаются дулоксетин и прегабалин .
АД имеют достоверный (но слабый) эффект при хронической поясничной боли . Наименьшее действие оказывают АД с преимущественной серотонинергической активностью.
Вопрос об эффективности АД и ПЭП при других ненейропатических состояниях (в том числе остеоартрите, ревматоидном артрите) требует дальнейшего изучения. Имеются данные небольших исследований с методологическими издержками, согласно которым, при использовании этих препаратов у 26–68% пациентов наблюдается половинная редукция выраженности болевого синдрома .
Литература